レプチン非依存性経路の発見
1-1 セロトニンネットワーク
1998年、Nonogakiら米国UCSFの研究グループは、摂食抑制と体重減少に関する「レプチン非依存性経路」の存在を世界で最初に発見し、セロトニン5-HT2C受容体のエネルギー代謝における新らたな役割を報告しました(Nonogaki K et al., Nat.Med 1998)。

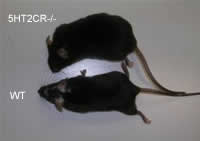
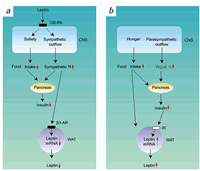
従来、視床下部の満腹中枢-交感神経系と摂食中枢-副交感神経系は、脳内スイッチのON,OFFで食欲と自律神経系が同様に制御されていると信じられていました。Nonogakiは、5-HT2C受容体欠損マウスでは若年成人期にレプチン非依存性過食と身体活動量の増加といった行動の変化が、インスリンやコルチコステロン等のホルモン異常を伴わずに生じ、その行動異常が持続すると、加齢に伴い2次的に交感神経系の白色脂肪組織へのシグナル伝達障害を起こして中年期肥満と代謝異常を生じてくることを見出しました。この事象を基に、食欲と自律神経系の中枢性制御は解離しており、生体内には中枢神経系と代謝器官間に「自律神経回路」が存在し、その回路の伝達障害が中年期肥満を誘発するという理論を世界で最初に提唱しました(Nonogaki K, Nat.Med 1999, Diabetologia 2000, Diabetes 2003)。
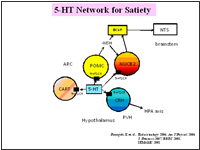
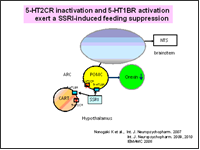
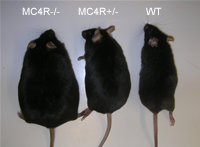
その後、5-HT2CRが、1)視床下部でPOMC, CART, beta-endorphin, NUCB2, Orexin, CRH等の様々なニューロンとネットワークを形成して食欲調節やストレス反応に携わっていること、2)前シナプスニューロンに存在する5-HT1BRと相補的に食欲のシグナル伝達を担うこと、3)抗うつ薬である選択的セロトニン再取り込み阻害薬(SSRI)の1種であるフルボキサミンの食欲抑制効果の発現には、逆に、5-HT2CRのシグナル伝達障害が必要になること、を見出してきました(Nonogaki K, BioFactors, 2013)。
一方、脳内5-HT2CRはセロトニン以外にもインクレチンのGLP-1や抗がん剤のCisplatinによる食欲抑制シグナルを受容することが報告され、5-HT2C受容体は、レプチン非依存性伝達経路の代表的受容体として、また、治療開発に重要な標的として再認識されつつあります。
我々は、5-HT2CRシグナル伝達系の制御因子と、非メラノコルチン系のシグナル伝達機構を解明すべき研究をしています。

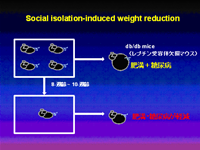
1-2 Social Isolationストレスによるエネルギー消費
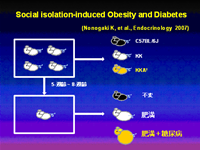
我々は、Social Isolationによる食欲抑制とエネルギー消費の亢進が,レプチン非依存性、かつ、セロトニン5-HT2C受容体非依存性の新しい経路によることを発見しました(Nonogaki K et al., Endocrinology 2007)。このSocial Isolationによる体重減少と24時間絶食後re-feedingによる“Catch up weight gain”には、加齢因子とβ-endorphinが影響を及ぼします(Nonogaki K et al., BBRC 2009)。更に、このSocial Isolationによる体重減少反応には視床下部領域のserum- and glucocorticoid-inducible kinase 1 (SGK1)と末梢組織のα-adrenergic receptorが関与することが示唆され、エネルギー消費における新たなレプチン非依存性交感神経経路として関心が持たれます(Kaji T et al., Front. Biosci, 2010)